毒瘤硫
一·硫的物理性质及存在
- 硫在自然界广泛存在,游离态的硫存在于火山口附近的地壳的岩层中。化合态的硫存在形式非常多,硫化物、硫的氧化物、蛋白质中等等。
- 硫是一种黄色晶体,俗称硫磺,质脆,易研制成粉末,微溶于酒精,易溶于二硫化碳($CS_2$)
单质硫的化学性质
- 与非金属反应
注意,硫与氧气反应只能生成$SO\_2$,要生成$SO\_3$,只能通过$SO\_2$与$O\_2$反应制得。$SO\_2$在水中易被氧化为$SO\_3$硫在空气中安静地燃烧,发出淡蓝色火焰,如果在纯的氧气中燃烧会发出蓝紫色火焰,都会有刺激性气味$SO_2$生成。\(S+O_2 \overset{点燃}{=}SO_2\)
·与$H_2$反应
硫与氢气在加热条件下反应,会有臭鸡蛋气味的气体$H_2S$生成。\(S+H_2\overset{\Delta}{=}H_2S\)
2.与金属反应
\(Fe+S\overset{\Delta}{=}FeS\) \(2Cu+S\overset{\Delta}{=}Cu_2S\) 注意,硫单质的氧化性恒弱,与金属反应往往只能将金属氧化到较低价态;常温下硫单质与汞反应生成硫化汞,可用于出去汞蒸气。
3.与浓硫酸反应
\(S+2H_2SO_4(浓)\overset{\Delta}{=}3SO_2\uparrow+2H_2O\) 硫单质能被自己的最高价氧化物所氧化,在元素推断题中会出现。
够骚气的了
4.与$NaOH$溶液反应
\(3S+6NaOH\overset{\Delta}{=}2Na_2S+Na_2SO_3+3H_2O\) 硫单质在强碱的水溶液中加热可以发生歧化反应,一般用于沾有硫粉的试管清洗
令人愉快的练习T1.下列说法不正确的是( ) A.硫是一种淡黄色的能溶于水的晶体 B.硫的化合物常存在于火山喷出的气体中和矿泉水里 C.硫元素的非金属性比氯元素弱 D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 T2.0.05 mol某单质与0.8 g硫在一定条件下完全反应,该单质可能是( ) A.$H_2$ B.$O_2$ C.$Na$ D.$Zn$
基础就这些,反正背就行了。其实我也背不到
硫的氧化物
一.二氧化硫—$SO_2$
1.$SO_2$的物理性质
$SO_2$是一种无色、有刺激性气味的有毒气体,密度比空气大,易液化(沸点$-10^。C$),易溶于水($1$体积水大约溶解$40$体积$SO_2$)
2.$SO_2$的化学性质
注意1.$SO\_2$可以使品红溶液褪色,加热又恢复红色,所以此方法常用于$SO\_2$的**检验**(1)$SO_2$可以使品红褪色,体现了$SO_2$的漂白性,工业上也会用$SO_2$来漂白草帽等(草帽用久了为什么会褪色?因为$SO_2$漂白生成的物质不稳定,受热易分解*但是氯水是永久性的,不可逆的)
| |氯水|二氧化硫| |–|:–:|:–:| |原理|$HClO$将有色物质氧化成无色无智|$SO_2$与有色物质化合生成不稳定的无色物质| |实质|氧化还原反应|非氧化还原反应| |效果|永久性|非永久性| |范围|能漂白大部分有色物质,能使紫色石蕊先变红后褪色|漂白某些有色物质(品红)使紫色石蕊只变红,不褪色| (2)$SO_2$与$H_2O$反应
$SO_2$溶于水生成亚硫酸,其水溶液显酸性,可以使石蕊变红;亚硫酸不稳定,易分解为水和二氧化硫(性质同$CO_3^{2-}$
做不来就当成碳酸来乱搞) \(SO_2\ +\ H_2O \leftrightharpoons H_2SO_3\)
(3)酸性氧化物的性质
ATTENTION:实验过程中的$SO\_2$尾气可以用$NaOH$吸收,同时若$SO\_2$过量,$SO\_2$会与$NaOH$反应生成$NaHSO\_3$,其水溶液显酸性 2.$SO\_2$也可以使澄清石灰水变浑浊,过量后,溶液有变成澄清可溶于水的$Ca(HSO\_3)\_2$1.$SO_2$与碱反应 \(2NaOH + SO_2=Na_2SO_3+H_2O\) \(Ca(OH)_2+SO_2=CaSO_3\downarrow+H_2O\)
(4)$SO_2$与某些盐反应
\(2SO_2(过量)+H_2O+Na2CO_3=2HaHSO_3+CO_2\) \(SO_2+NaHCO_3=NaHSO_3+CO_2\) 其实在处理$SO_2$的时候,有些~大部分~~情况当成$CO_2$处理就好了,但是注意强酸制弱酸的时候,毕竟$SO_2^{2-}$酸性大于$CO_3^{2-}$
(5)$SO_2$的还原性
$SO_2$中的硫的化合价是
+4价,处于中间价态,因此,既可以被还原乐,也可以被氧化。 \(2SO_2+O_2 \overset{V_2O_5(催化剂)500^。C}{\leftrightharpoons}2SO_3\) \(SO_2+X_2+2H_2O=H_2SO_4+2HX(X_2:Cl_2/Br_2/I_2)\) \(5SO_2+2KMnO_4+2H_2O=K_2SO_4+2MnSO_4+2H_2SO4\) 所以,$SO_2$可以使酸性高锰酸钾,氯水,溴水等褪色,即被还原。也可以被$Fe^{3+}、HNO_3$等氧化剂氧化。弱氧化,强还原
(6)$SO_2$的氧化性
\(SO_2+2H_2S=3S\downarrow+2H_2o\) \(SO_3^{2-}+2S^{2-}+6H^+=3S\downarrow + 3H_2O\)
硫酸及硫酸盐
一、$H_2SO_4$的物理性质
浓硫酸为无色油状液体,密度大于水(98%的浓$H_2SO_4$ $\rho = 1.84g/mL$),沸点高,难挥发,溶于水时会放出大量的热。
二、硫酸的化学性质
1.$H_2SO_4$为二元强酸,稀硫酸在化学反应中主要表现酸($H^+$)的性质 2.浓$H_2SO——4$的性质 1.吸水性
浓$H_2SO_4$具有吸水性故常用作气体干燥剂,常用于干燥中性、酸性气体,不能用于干燥碱性气体(氨气) 和还原性气体($H_2S \ \ HI\ \ \ HBr$等)
(2)脱水性
将有机物中 $H$ 和 $O$ 原子按原子个数比为$2:1$的比例脱出并生成水,例如:浓硫酸可以使蔗糖碳化:
(3)强氧化性
钝化 常温下浓硫酸、浓硝酸能使铁、铝表面形成致密的氧化膜,从而阻止酸与内部金属继续反应,这种现象称为“钝化”,因此可以用铁罐运输浓硫酸。欲使浓硫酸与该金属反应时,常需要加热。
(4)与金属反应
浓硫酸的氧化性很强,能够与大多数的金属发生氧化还原反应。 \(Cu+2H_2SO_4(浓)\overset{\Delta}{=}SO_2\uparrow+CuSO_4+2H_2O\) \(2Fe+6H_2SO_4(浓)\overset{\Delta}{=}Fe_2(SO_4)_3+3SO_2\uparrow +6H_2O\) [注意]当铁粉过量时,可以将溶液中的三价铁还原至二价铁,方程式也可以根据两式相加.在书写离子方程式时浓硫酸不能拆开来写,要写成分子的形式。
(5)与非金属反应 \(C+2H_2SO_4(浓)\overset{\Delta}{=}CO_2\uparrow+2SO_2+2H_2O\) \(S+2H_2SO_4(浓)\overset{\Delta}{=}3SO_2\uparrow +2H_2O\)
(6)与还原性的离子反应 浓硫酸能够将$Fe^{2+},Br^-,I^-$等具有还原性的离子氧化。
三、几种常见的硫酸盐
|俗称|化学式|用途| |:–:|:–:|:–:| |明矾(白矾)|$KAl(SO_4)_2-12H_2O$|净水剂| |胆矾|$CuSO_4-5H_2O$|配波尔多液,杀菌消毒| |绿矾|FeSO_4-7H_2O|补铁药剂| |石膏|CaSO_4-2H_2O|装饰材料,水泥的硬化调节剂| 四、硫酸根的检验 先加入稀盐酸进行酸化,再滴$BaCl_2$溶液,若出现白色沉淀,说明溶液中存在$SO_4^{2-}$ 【注意】加稀盐酸的目的是排除溶液中的$SO_3^{2-}\ \ CO_3^{2-} Ag^+$等离子;不能使用稀硝酸进行酸化也不能滴硝酸钡的原因是: 防止溶液中存在$SO_3^{2-}$而被氧化 成$SO_4^{2-}$ ,影响检验结果。
令人愉快的练习
丧心病狂的T3.某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
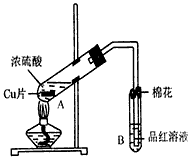 (1)写出试管B中的实验现象________。
(2)写出A中反应的化学方程式______。
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:______。若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式)__、
____。
(4)B试管口的棉花应沾有的试剂是____。
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值。
①在他们的实验操作中,至少称量__次;
②下面是其中一次实验的数据:
(1)写出试管B中的实验现象________。
(2)写出A中反应的化学方程式______。
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:______。若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式)__、
____。
(4)B试管口的棉花应沾有的试剂是____。
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值。
①在他们的实验操作中,至少称量__次;
②下面是其中一次实验的数据:
 根据上表数据计算判断x的实侧值比理论值(x=5)__(填“偏大”、“偏小”),这次实验中产生误差的原因可能是_______(填序号)
A.硫酸铜晶体中含有不挥发的杂质
B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去
D.加热失水后露置在空气中冷却
根据上表数据计算判断x的实侧值比理论值(x=5)__(填“偏大”、“偏小”),这次实验中产生误差的原因可能是_______(填序号)
A.硫酸铜晶体中含有不挥发的杂质
B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去
D.加热失水后露置在空气中冷却
T4:以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生的反应方程式为____.
(2)接触室中发生反应的化学方程式是、
(3)依据工艺流程图判断下列说法正确的是(填字母).
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高$SO_2$的转化率
c.使用催化剂能提高$SO_2$的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的$SO_2$和铵盐.
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的$Br_2\ \ SO_2$吸收$SO_2$的离子方程式是________.
T5:题也比较少,建议把必刷题做完其实十多分钟就做完了
参考答案及详细简略解析
T1:答案AD 解析:无论在空气中还是在氧气中,$S$的燃烧产物都是$SO_2 $,不随$O_2$ 量的变化而变化. T2:答案C 解析:$n(S)=\frac{0.8g}{32g·mol^{-1 }} =0.025mol$,该单质与硫的物质的量之比是$2∶1$所以该单质在$4$个选项中只能是$K$. T3:品红溶液褪色 (2)$Cu+2H_2SO_4(浓) CuSO_4+SO_2↑+2H_2O$ (3)$Cu+H_2O_2+2H^+=Cu_2^++2H_2O;Fe_2O_3;NaNO_3$ (4)$NaOH$(溶液)或$KMnO 4$(溶液)(其它合理答案也可以) (5)①4;②偏大;BC T4:$4FeS_2+11O_2\overset{高温}{=}2Fe_2O_3+8SO_2$ $2SO_2+O_2\overset{催化剂\Delta}{\leftrightharpoons}2SO_3$ abd $SO_2+Br_2+2H_2O=4H^++2Br^-+SO_4^{2-}$
